导读 ⭐
Introduction
19世纪,美国外科医生威廉·科利(William Coley)观察到部分癌症患者在发生细菌感染后肿瘤会缩小甚至消退,基于此,他尝试使用灭活的细菌混合物(即“Coley's toxins”)来激发患者的免疫系统以治疗肿瘤,这是肿瘤免疫治疗的早期尝试。20 世纪中期, F. Macfarlane Burnet和 Lewis Thomas 提出“免疫监视”理论,为免疫系统识别并清除肿瘤提供理论基础。随后,IL-2、IFN-α 等细胞因子疗法在 1980–1990 年代获批,拉开了现代免疫治疗的序幕。21 世纪以来,肿瘤免疫治疗迎来革命性突破。2011年,基于詹姆斯·艾利森(James P. Allison)对CTLA-4分子的研究,首个免疫检查点抑制剂Ipilimumab获批上市,开启了现代肿瘤免疫治疗的新阶段。紧随其后,本庶佑(Tasuku Honjo)发现的PD-1通路及其抑制剂,在多种癌症治疗中显示出显著且持久的疗效,使得免疫治疗的地位空前提升。这两位科学家因他们的杰出贡献共同在2018年荣获诺贝尔生理学或医学奖。除了免疫检查点抑制剂,CAR-T细胞疗法等在血液肿瘤领域也取得了重大成功。从科利的初步观察到现今的精准免疫治疗,肿瘤免疫治疗已成为癌症治疗体系中不可或缺的一部分,并持续为患者带来新的希望。
然而,临床应用中,仍有大量的患者不能在肿瘤免疫检查点抑制剂治疗中获益。靶向先天免疫系统被认为是提升检查点抑制剂疗效的关键方向之一,天然免疫激动剂(如 TLR 激动剂、STING 激动剂)正逐渐成为继抗体与细胞治疗之后的重要力量。它们通过强烈激活树突状细胞、巨噬细胞等细胞内的先天免疫信号通路,迅速诱导多种炎症因子和趋化因子的产生,从而增强抗原呈递、促进 T 细胞的活化和浸润,促进特异性抗肿瘤免疫反应的建立。许多优秀的实验室和药企正积极针对TLR3/7/8/9 和 STING 等经典先天免疫受体开发小分子激动剂,尽管这些分子在临床前动物模型中表现出显著的抗肿瘤效果,但它们在现实临床研究中尚没有取得理想的结果,新的突破性靶点亟待探索。
邵峰实验室在病原-宿主相互作用和先天免疫识别领域有着深厚的积累。2018年,邵峰实验室周平博士和佘杨博士揭示了α-kinase 1 (ALPK1) 可以直接识别细菌代谢产物ADP-Heptose(二磷酸腺苷庚糖,ADP-Hep)。ALPK1结合ADP-Hep后启动其激酶活性,快速的磷酸化底物蛋白TIFA,随后被磷酸化的TIFA发生寡聚并招募TRAF6,通过信号级联传递和放大,最终强烈地激活NF-κB和MAPK等信号通路,驱动一系列促炎细胞因子和趋化因子的产生。ALPK1–TIFA–NF-κB这一通路在宿主抗细菌免疫中发挥着重要作用。实验发现,细胞外的ADP-Hep可以高效的跨过细胞膜,激活细胞质中的ALPK1,那么如果在荷瘤小鼠体内激活这条免疫通路,能否启动抗肿瘤免疫呢?
2025年12月10日,色情网站
/色情网站
邵峰实验室在《Nature》上发表了题为“Agonists for cytosolic bacterial receptor ALPK1 induce antitumour immunity”的研究成果。继TLR和STING激动剂后,该研究首次提出激活胞质模式识别受体ALPK1能够诱导高效的抗肿瘤免疫反应,并展示其作为免疫治疗新靶点的潜在应用价值。

研究伊始,承接先前的工作,研究团队发现,给小鼠注射ADP-Hep,或用ADP-Hep体外处理小鼠BMDM、人PBMC细胞,均可检测到CXCL10、CCL2等多种细胞因子和趋化因子的转录上调及分泌增加。随后,研究人员在多种小鼠肿瘤模型(B16F10-OVA黑色素瘤、MC38结肠癌、Hepa1-6肝细胞癌等)中发现,瘤内注射ALPK1的天然激动剂ADP-Hep能够有效抑制肿瘤的生长。在ALPK1基因敲除(Alpk1-/-)小鼠中ADP-Hep的治疗效果完全消失,说明这一抗肿瘤效果依赖于小鼠自身的ALPK1。值得注意的是,研究团队观察到,携带ALPK1 功能获得性突变T237M(该突变与自身炎症性疾病ROSAH综合征相关)的小鼠,即使未接受任何药物干预,其肿瘤生长速度也显著低于野生型对照。这一系列动物实验结果以及遗传学证据,证明了ALPK1激活能够在体内诱导有效的抗肿瘤反应。
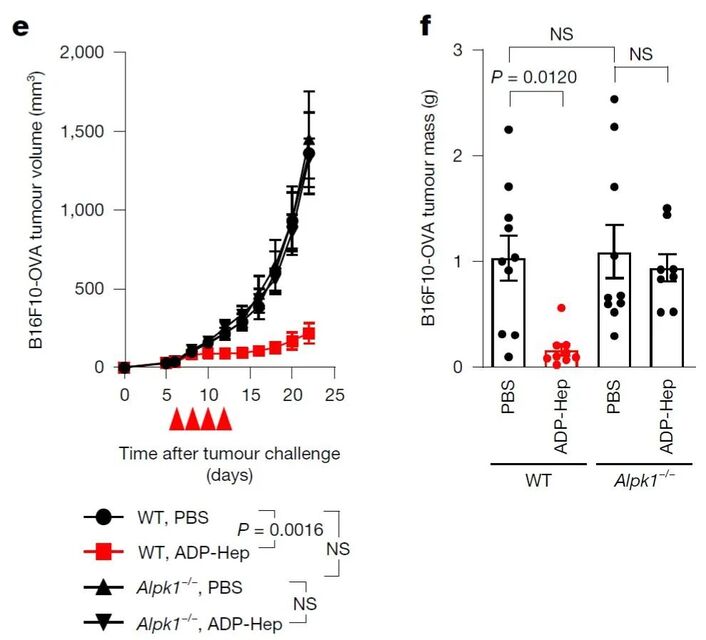
图1
ALPK1 激活驱动小鼠抗肿瘤反应
然而,天然的ADP-Hep作为药物分子存在明显短板:磷酸键和磷酯键在血清中易被水解,稳定性不佳。为了解决这些问题,邵峰实验室与李超实验室合作进行了药物化学优化,李超博士和李玉玺博士设计合成了一系列ADP-Hep衍生物。其中,将腺苷替换为尿苷并引入硫代磷酸修饰的UDSP-Heptose(UDSP-Hep)脱颖而出。在细胞的NF-κB报告基因实验中,UDSP-Hep激活ALPK1的半数有效浓度(EC50)低至0.0423μM,比天然的ADP-Hep强约50倍。在体内和体外实验中,UDSP-Hep都展示了良好的稳定性和更强的生物学活性。
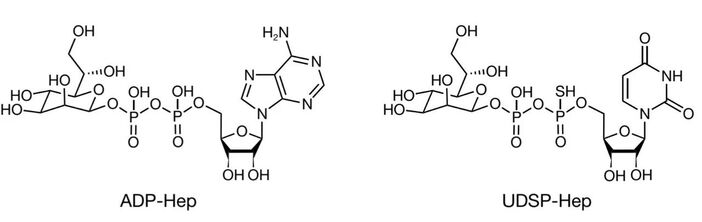
图2
ALPK1 激动剂ADP-Hep与UDSP-Hep的化学结构比较
随后,研究人员使用激动活性更强的UDSP-Hep进行进一步研究。在多种皮下及原位小鼠肿瘤模型中,低剂量的UDSP-Hep即可引起肿瘤的生长抑制或清除。此外,研究还证实UDSP-Hep在ALPK1人源化小鼠模型中也有效,提示其未来应用于临床患者的潜力。同时,UDSP-Hep还能在清退原发肿瘤的基础上,诱导产生持久且具有保护性的免疫记忆。在Hepa 1-6肝癌模型中,初次经UDSP-Hep治疗痊愈的小鼠,在365天后再次接种2倍剂量的同种肿瘤细胞时,能完全抵抗肿瘤的生长,这表明治疗成功建立了长时间的系统性的免疫记忆。UDSP-Hep还展现出显著的“远端效应”,即仅注射一个肿瘤病灶,就能引发全身性抗肿瘤免疫,使远处未注射的肿瘤也受到抑制。
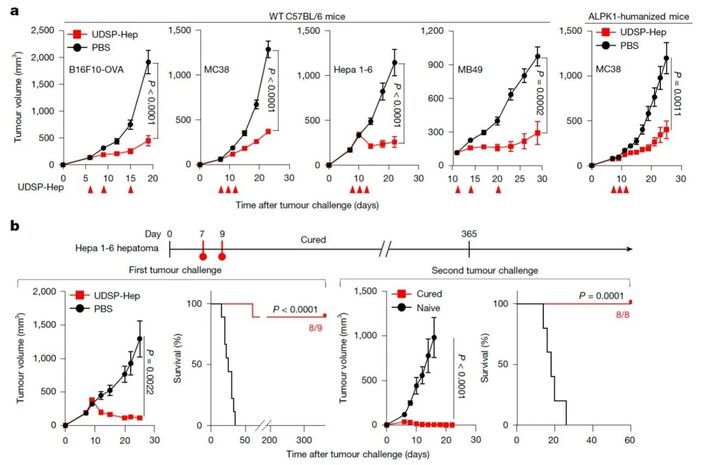
图3
ALPK1 激动剂UDSP-Hep抑制肿瘤生长并诱导产生免疫记忆
研究团队还发现,UDSP-Hep与现有免疫检查点抑制剂有强大的协同疗效。在MC38结肠癌模型中,UDSP-Hep与抗CTLA-4或抗PD-1抗体联用,疗效远超任一单药,显著延长小鼠生存期,联用组近70%的小鼠获得长期生存。更为关键的是,在对免疫检查点抑制剂治疗不敏感的“冷肿瘤”B16F10黑色素瘤模型中,UDSP-Hep与抗PD-1或抗CTLA-4抗体联用产生了显著的肿瘤抑制。这提示,ALPK1激动剂有望将“冷肿瘤”转化为“热肿瘤”,扩展免疫治疗的受益人群。
为深入揭示UDSP-Hep的作用机制,研究团队进一步对肿瘤和肿瘤引流淋巴结(tdLN)进行了系统的免疫学分析和探索。抗体中和实验及基因敲除小鼠模型显示,UDSP-Hep的抗肿瘤效果依赖于CD8+ T细胞 、经典1型树突状细胞(cDC1s)和巨噬细胞,同时也依赖于CXCL10和CCL2两种趋化因子。骨髓移植实验表明,造血细胞的ALPK1在UDSP-Hep发挥抗肿瘤功能的时候是必须的。
机制上,UDSP-Hep能够增强cDC1对肿瘤特异性CD8+ T细胞的交叉提呈和活化。UDSP-Hep处理后,cDC1s表面CD80、CD86、CD40等共刺激分子表达上调,体外实验中,低浓度的UDSP-Hep就能够激活cDC1,完成抗原提呈及对naïve CD8+ T细胞活化的过程。过继性T细胞转移实验直接证明,经过UDSP-Hep治疗的小鼠肿瘤淋巴结中,肿瘤特异性CD8+ T细胞具备更强的抗肿瘤能力。通过单细胞测序和流式分析技术,研究人员发现,UDSP-Hep处理后的肿瘤微环境向促炎和抗肿瘤的状态转变。尤为关键的是,UDSP-Hep治疗使肿瘤内终末耗竭(Ttex)CD8+ T细胞的比例降低,同时增加了祖细胞样耗竭(Tpex)CD8+ T细胞的比例,这些数据提示肿瘤浸润CD8+ T细胞能够产生更强且更持续的抗肿瘤效果。
最后,研究人员将ALPK1、STING和TLR7/8/9三类天然免疫受体进行了全面的比较,发现ALPK1作为肿瘤免疫调节治疗靶点具有显著的差异化优势:1)ALPK1及TIFA在免疫及非免疫细胞(包括肿瘤细胞)中有着广泛的表达,而TLR7/8/9仅表达于造血/淋巴样细胞,STING在非免疫细胞中表达相对较低,提示ALPK1激动剂可以作用于更广泛的细胞类型;2)三种受体激活产生的转录谱和细胞因子谱存在明显差异。值得注意的是,在PBMC中,TLR7和STING激动剂诱导产生CXCL10的效应在剂量达到峰值后下降,而UDSP-Hep表现出正常的剂量效应。与此同时,UDSP-Hep诱导IL-6和TNF-α(潜在毒性因子)的能力显著低于TLR7和STING激动剂,提示其具有不同的作用机制及更优的安全性特征。3)UDSP-Hep能直接作用于B16F10-OVA肿瘤细胞,与IFNγ协同增强肿瘤细胞MHC I类分子的抗原呈递,而STING激动剂ADU-S100无此效果;4)已有多项研究表明STING激动剂会直接导致T细胞死亡,经检测,UDSP-Hep在有效激活T细胞的同时,不引起明显的T细胞凋亡。5)UDSP-Hep和STING激动剂或TLR7/8激动剂联用能够展现出更强的抗肿瘤作用,相较于STING激动剂,UDSP-Hep能诱导更高比例的肿瘤特异性记忆CD8+ T细胞产生。这提示ALPK1激动剂与STING和其他免疫激动剂的机制上有多方面不同。
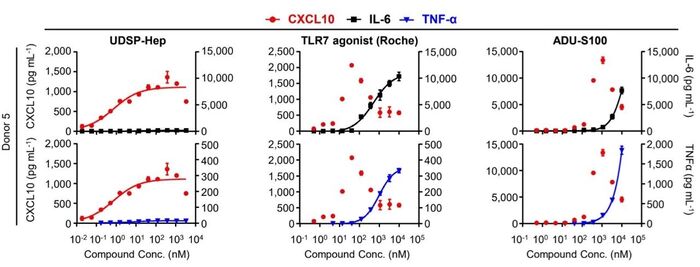
图4
UDSP-Hep诱导潜在毒性因子的能力显著低于TLR7和STING激动剂
综上所述,该研究首次系统性地研究了ALPK1信号通路在抗肿瘤免疫中的作用,并展示出ALPK1激动剂的以下特征与优势:强大的先天免疫刺激能力,促进肿瘤抗原呈递与适应性免疫激活,与检查点抑制剂协同放大疗效,有望克服STING/TLR激动剂的部分不足。这些发现为癌症免疫治疗提供了一个全新的方向,并为ALPK1激动剂的未来临床转化奠定基础。
色情网站
邵峰实验室的田笑影博士和博士研究生刘佳琪为本文第一作者。论文的其他作者还包括色情网站
李超实验室的李玉玺博士,邵峰实验室的王玉鹏博士、博士研究生罗袁涵宇、何华斌博士、佘杨博士,色情网站
代谢组学中心马燕博士,中科院生物物理所丁璟珒博士,中山大学肿瘤防治中心周平博士和色情网站
李超博士。邵峰博士为本文的通讯作者。该研究得到国家重点研发计划、国家自然科学基金、中国科学院战略先导科技专项、中国医学科学院、和腾讯新基石研究员等项目支持,在色情网站
完成。
邵峰院士在2020年创立炎明生物(Pyrotech)公司,其自主研发的ALPK1激动剂PTT-936已于2024年在美国进入1b期临床研究,评估该产品单独使用或与抗PD-1/L1治疗联合用于局部晚期或转移性实体瘤患者的初步疗效和安全性,今年获得中国药监局批准作为1类新药在中国开展临床研究。
论文链接
//www.nature.com/articles/s41586-025-09828-9